
Når sjøtemperaturen synker om vinteren, øker risikoen for sårutvikling hos oppdrettsfisk. God overvåkning og riktige prøverutiner er avgjørende for å oppdage og håndtere bakterielle sårproblemer tidlig. Her får du oversikt over de viktigste bakteriene, anbefalte rutiner for prøvetaking og innsending, samt tips om videre analyser.
Lavere vanntemperaturer gir økt forekomst av sår hos oppdrettsfisk. Dette skyldes at bakterier trives under slike forhold, og fisken kan bli mer mottakelig for infeksjoner.
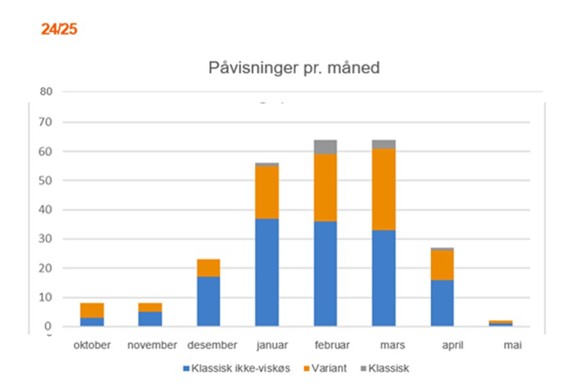
De vanligste sårbakteriene er fortsatt Moritella viscosa og Tenacibaculum finnmarkense. Andre bakterier, som Aliivibrio wodanis og ulike Vibrio-arter, kan også bidra til sykdomsbildet.
For å kartlegge sårproblemer best mulig, anbefaler vi mikrobiologisk analyse. Dette gir oversikt over hvilke bakterier som er til stede, og isolatene kan videre karakteriseres med flere metoder.
Våre anbefalinger:
To prøvetyper kan benyttes:
Andre analysemetoder:
Har du spørsmål om prøvetaking eller bakterier?
Kontakt din kundekontakt eller ansvarlig for mikrobiologi, Hege Hellberg.
Les mer om de ulike metodene for karakterisering av M. viscosa i denne artikkelen: Karakterisering av Moritella viscosa
PHARMAQ er verdens ledende selskap innen vaksiner og innovasjon rettet mot akvakulturnæringen og er en del av Zoetis, verdens ledende selskap innen dyrehelse. Våre innovative fiskehelseløsninger inkluderer et bredt spekter som fiskevaksiner, terapiprodukter, vaksinasjonsmaskiner inkludert servicetjenester, forskning og analyser. Selskapet leverer miljøvennlige, trygge og effektive helseprodukter til den globale akvakulturnæringen ved hjelp av målrettet forskning og engasjerte medarbeidere. Produksjon, administrasjon, forskning og utvikling ligger i Norge og med global virksomhet i kommersielle oppdrettsmarkeder har PHARMAQ rundt 375 medarbeidere. Konsernets produkter markedsføres i Europa, Nord- og Sør-Amerika samt i Asia. For mer informasjon, se selskapets hjemmeside: www.pharmaq.com. Personvernerklæring Erklæring om informasjonskapsler (cookies) Bruksvilkår
Copyright © 2020 Zoetis LLC. Alle rettigheter forbeholdt.